Desmosin è un amminoacido proteinogenico. Insieme ad altri amminoacidi, forma la fibra e l'elastina proteica strutturale. Con mutazioni nel gene ELN, la struttura dell'elastina è disturbata.
Cos'è la desmosina?
Gli amminoacidi sono una parte importante dell'organismo umano. Sono una classe di composti organici formati da almeno un gruppo carbossilico e un gruppo amminico. Gli amminoacidi sono quindi sia acidi carbossilici che ammine.
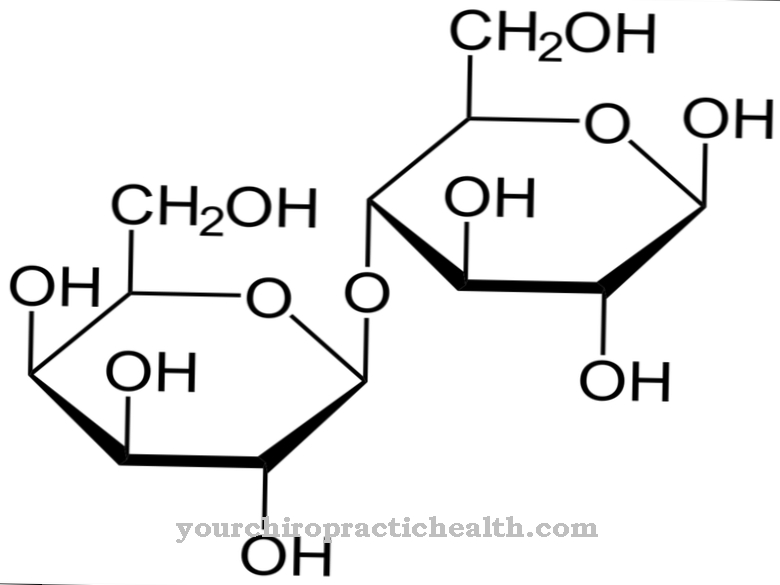
A seconda della loro posizione rispetto al gruppo carbossi, gli amminoacidi possono essere assegnati a diversi gruppi. Gli amminoacidi con un gruppo carbossilico terminale sono chiamati geminali o α e si contano tra gli α-amminoacidi. Questi amminoacidi sono elementi delle proteine. Il corpo umano ha più di 20 aminoacidi proteinogenici e 400 aminoacidi non proteinogenici. Gli amminoacidi D sono un gruppo speciale. Uno degli oltre 20 aminoacidi proteinogenici è la desmosina, che insieme all'isodesmosina costruita in modo simile forma la fibra proteica elastina.
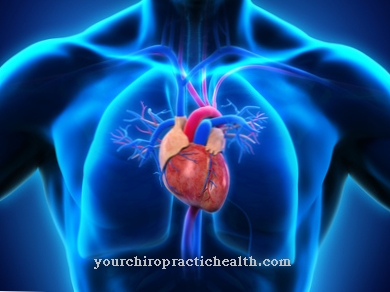
L'elastina e il suo precursore solubile tropoelastina appartengono alle proteine strutturali e contribuiscono alla formazione e alla ritenzione delle strutture anatomiche. L'elastina svolge un ruolo speciale nella capacità di allungare i grandi vasi sanguigni, ad esempio l'aorta.
Funzione, effetto e compiti
La desmosina è formalmente un amminoacido quadruplo. Ha un anello di piridinio al centro. La piridina è un composto chimico con la formula empirica C5H5N, che può essere assegnato ai sistemi parentali eterociclici e forma l'azina più semplice sotto forma di un anello a sei membri con un atomo di azoto e cinque atomi di carbonio.
Grazie al suo anello centrale di piridinio, la desmosina può mettere in rete i singoli filamenti proteici nella fibra proteica elastina. La composizione dell'elastina è simile a quella del collagene. Invece dell'idrossilisina, tuttavia, l'elastina ha una percentuale significativa di valina. I residui di lisina vengono ossidati ad allysina dall'enzima lisil ossidasi. Tre allysine e una lisina formano a loro volta una desmosina a forma di anello. Questa forma gioca un ruolo significativo nell'elasticità di un'intera molecola di elastina.
In quanto rete proteica, l'elastina è costituita da unità legate alla desmosina ed è estensibile elasticamente. I polmoni, la pelle e i vasi sanguigni dipendono dall'elastina e dalla sua componente desmosina, poiché solo così ottengono la loro notevole elasticità. La desmosina emette una fluorescenza blu alla luce UV e conferisce all'elastina il suo colore giallo, la sua insolubilità in acqua, stabilità al calore e resistenza agli alcali e alle proteasi.
Istruzione, occorrenza, proprietà e valori ottimali
La formazione della desmosina è anche nota come biosintesi della desmosina. Durante questa biosintesi, i gruppi amminici terminali delle unità di L-lisina vengono convertiti in ω-aldeidi dall'enzima lisil ossidasi attraverso l'ossidazione.
La lisil ossidasi è una proteina lisina 6 ossidasi e quindi corrisponde a un enzima che si trova nello spazio extracellulare del tessuto connettivo. Nella reticolazione di elastina e collagene, funge da catalizzatore e stabilizzatore meccanico per le proteine. Durante la biosintesi della desmosina, la lisil ossidasi converte la lisina in allysina. Questo processo avviene nella matrice extracellulare e stabilizza le connessioni incrociate tra collagene ed elastina Dal punto di vista chimico la reazione corrisponde alla deaminazione ossidativa per formare l'aldeide. Allysine forma allysinaldol o desmosine con residui di aldeide di molecole di tropelastina vicine attraverso una condensazione aldolica.
La lisina rimanente forma una base di Schiff tramite il suo gruppo amminico e crea isodesmosina. Oltre ai vasi sanguigni, ai polmoni e alla pelle, tutte le microfibrille in particolare trasportano la desmosina. Queste sono le fibre più piccole del tessuto collageno, reticolare ed elastico.
Malattie e disturbi
La formazione di elastina da componenti come la desmosina viene interrotta in varie malattie. Queste malattie includono principalmente mutazioni nel gene ELN. Le più importanti di queste sono la dermatochalasis, la sindrome di Williams-Beuren e la stenosi aortica congenita sottovalvolare. La dermatochalasis è un gruppo di alterazioni del tessuto connettivo con accumulo familiare.
Caratteristica di questo gruppo è la pelle cascante, meno elastica e rugosa su varie parti del corpo. Il gene ELN codifica per l'elastina e può causare tali sintomi attraverso una mutazione. La sindrome di Williams-Beuren è piuttosto rara rispetto a questa, colpendo solo uno su 20.000 neonati. La malattia è causata da un difetto sul cromosoma sette. Il locus genetico è 7q11.23. A causa di un difetto a questo punto, la persona colpita non dispone del gene dell'elastina e dei geni vicini. La delezione del gene dell'elastina causa dismorfismi facciali e disturbi nella struttura degli organi interni. Possono verificarsi difetti cardiaci come la stenosi aortica sopravalvolare e malformazioni renali come il rene a ferro di cavallo o la stenosi vascolare renale. Inoltre, c'è spesso una disabilità cognitiva.
Le capacità mentali delle persone colpite sono inferiori alla media. Nonostante l'espressività verbale, per lo più formano frasi con poco contenuto. Iniziano a leggere in tenera età, il che spesso sopravvaluta le loro capacità mentali. Oltre alla loro iperlessia, il loro tono perfetto porta spesso a sopravvalutazioni. Come forma di mutazione dell'elastina, la stenosi aortica congenita sottovalvolare corrisponde a sua volta a una malformazione cardiaca associata a un restringimento dell'arteria maggiore. La stenosi sopravalvolare si trova sopra la valvola aortica all'inizio dell'aorta.
Questa forma del difetto cardiaco è spesso caratterizzata da costrizioni a forma di clessidra che si trovano sopra l'uscita dei vasi coronarici. Anche la parte ascendente dell'aorta può essere ristretta. Questa forma di stenosi aortica si verifica particolarmente spesso nel contesto della sindrome di Williams-Beuren appena discussa. Questo difetto cardiaco è già stato osservato indipendentemente dalla malattia. In questo caso, tuttavia, non deve essere necessariamente correlato a una mutazione nel gene dell'elastina.


.jpg)