Il Sintesi dell'emoglobina è composto dalla sintesi dell'eme e dalla sintesi della globina. Infine, il gruppo eme protesico, ciascuno con quattro globine, è legato all'emoglobina del complesso proteico contenente ferro. Disturbi sia nella sintesi dell'eme che nella sintesi della globina possono portare a gravi problemi di salute.
Cos'è la sintesi dell'emoglobina?

Per comprendere la sintesi dell'emoglobina, è prima necessaria la conoscenza della struttura dell'emoglobina. L'emoglobina è un complesso proteico contenente ferro, costituito da quattro subunità di globina, ciascuna con un gruppo eme protesico.
Nell'emoglobina umana adulta ci sono due alfa globine identiche e due beta globine identiche come subunità. Ciascuna di queste subunità è legata a un gruppo eme protesico, che consiste in un complesso di porfirina ferro (II). Quindi un complesso di emoglobina contiene quattro gruppi eme.
A seconda dell'ambiente chimico, ogni gruppo eme può legare una molecola di ossigeno allo ione ferroso in modo complesso. A seconda di quanti gruppi eme sono caricati con ossigeno, si parla di ossiemoglobina (ad alto contenuto di ossigeno) o deossiemoglobina (a basso contenuto di ossigeno).
Lo ione ferroso si trova al centro dell'anello porfirinico. A lato è presente un complesso legame con il residuo istidinico della globina. D'altra parte, a seconda dello stato energetico dello ione ferro, una molecola di ossigeno può essere legata in un complesso. Lo stato energetico è influenzato dalle condizioni fisiche e chimiche esterne dovute a cambiamenti nella conformazione della globina.
Funzione e compito
L'ultimo passaggio nella sintesi dell'emoglobina consiste nell'assemblare il gruppo eme protesico con le quattro unità globiniche per formare un complesso proteico contenente ferro. I singoli componenti sono formati da percorsi biosintetici indipendenti.
I materiali di partenza per l'anello porfirinico del gruppo eme sono gli amminoacidi glicina e succinil-CoA. Il succinil-CoA è composto da coenzima A e acido succinico. L'acido succinico è un prodotto intermedio nella scomposizione dei corpi chetonici ricchi di energia come parte del metabolismo energetico. Con l'aiuto dell'enzima sintetasi dell'acido delta-aminolevulinico, l'acido delta-aminolevulinico viene sintetizzato da succinil-CoA e glicina. Due molecole di acido delta-aminolevulinico si condensano con l'eliminazione di una molecola di acqua per formare il derivato pirrolico porfobilinogeno. Con l'eliminazione dell'ammoniaca e con l'aiuto dell'enzima uroporfirinogeno-I sintetasi, quattro molecole di porfobiliogeno reagiscono per formare idrossimetilbilano. Questo viene trasformato in uroporfirinogeno III con formazione di anelli.
La protoporfirina viene prodotta attraverso la decarbossilazione enzimatica e la disidratazione nei mitocondri. Con l'enzima ferrochelatasi, uno ione ferro (II) viene incorporato in questa molecola con la formazione di eme. Nel citosol della cellula, l'eme è legato alla proteina globina per formare l'emoglobina del complesso proteico contenente ferro.
La sintesi delle singole globine avviene tramite la normale biosintesi proteica. Come già accennato, il complesso dell'emoglobina adulta contiene due subunità identiche di alfa e beta globine. A causa della sua struttura complessa, l'emoglobina finita ha sviluppato la capacità di trasportare ossigeno e fornirlo a tutte le cellule dell'organismo.
Tuttavia, il legame del ferro centrale all'ossigeno non è molto stretto e può essere influenzato molto facilmente da fattori chimici e fisici esterni. Ciò consente all'emoglobina di assorbire e rilasciare rapidamente ossigeno. Il contenuto di ossigeno dell'emoglobina dipende, tra l'altro, dai fattori pH, anidride carbonica o pressione parziale o temperatura dell'ossigeno. Queste variabili influenzanti cambiano, ad esempio, la conformità delle globine, in modo che il legame ossigeno possa essere rafforzato o indebolito da lievi variazioni delle condizioni energetiche e steriche.
Con un valore di pH basso e una pressione parziale di anidride carbonica elevata, il legame dell'ossigeno allo ione ferro (II) è indebolito e quindi il rilascio di ossigeno è favorito. Proprio in queste condizioni si verifica un turnover metabolico più forte, che ha anche una maggiore richiesta di ossigeno. Il sistema di trasporto dell'ossigeno è quindi coordinato in modo ottimale con le esigenze fisiche tramite la funzione dell'emoglobina.
Malattie e disturbi
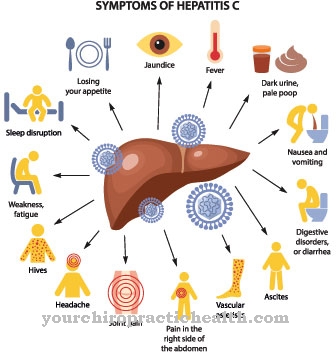
I disturbi nella sintesi dell'emoglobina possono portare a varie malattie. Esistono numerose malattie genetiche che si basano sull'interruzione della sintesi dell'eme. Nel processo, i precursori dell'eme si accumulano nel corpo, il che tra le altre cose porta a un'estrema sensibilità alla luce. In queste cosiddette porfirie, le porfirine sono immagazzinate nei vasi sanguigni o persino nel fegato. Quando esposte alla luce, alcune forme di porfiria immagazzinano più energia di radiazione. Quando l'energia viene rilasciata, vengono creati i radicali dell'ossigeno che attaccano e distruggono il tessuto esposto. Questo porta a forte prurito e bruciore.
Esistono sette forme di porfido. La costruzione dell'eme è un processo in otto fasi in cui sono coinvolti sette enzimi. Se un enzima funziona solo in modo inadeguato, il rispettivo precursore viene immagazzinato a questo punto nella sintesi dell'eme. In base ai sintomi, le porfirie si dividono in due gruppi principali. Le cosiddette porfirie cutanee sono caratterizzate dalla dolorosa sensibilità della pelle alla luce.Nelle porfirie epatiche, l'interessamento epatico predomina con forte dolore addominale, nausea e vomito. In molti casi, tuttavia, c'è una sovrapposizione tra i due complessi sintomatici.
Le porfirie mostrano spesso un decorso intermittente con attacchi acuti. A seconda del tipo di porfiria, questi si manifestano in reazioni cutanee improvvisamente dolorose, coliche addominali, nausea / vomito, colorazione rossa delle urine, convulsioni, deficit neurologici o anche psicosi.
Altri disturbi della sintesi dell'emoglobina riguardano la sintesi difettosa di molecole di globina attraverso mutazioni nei geni corrispondenti. Esempi sono la cosiddetta anemia falciforme o talassemia. Nell'anemia falciforme, la proteina della subunità beta globina è geneticamente modificata. Nella posizione sei di questa proteina, l'amminoacido acido glutammico è stato sostituito dalla valina. In caso di mancanza di ossigeno, l'emoglobina interessata diventa a forma di falce, si aggrega e ostruisce i piccoli vasi sanguigni. Ciò si traduce in disturbi circolatori pericolosi per la vita. Le talassemie sono un gruppo di diverse malformazioni dell'emoglobina che portano alla ridotta formazione di catene globiniche di alfa o beta globina. L'anemia grave è il sintomo più importante.





.jpg)

.jpg)


.jpg)



.jpg)