Proteine strutturali servono principalmente come costruttori di trazione nelle cellule e nei tessuti. Di solito non hanno funzione enzimatica, quindi normalmente non interferiscono con i processi metabolici. Le proteine strutturali di solito formano fibre lunghe e danno z. B. legamenti, tendini e ossa la loro forza e motilità, la loro mobilità. Diversi tipi diversi di proteine strutturali costituiscono circa il 30% di tutte le proteine presenti nell'uomo.
Qual è la proteina strutturale?
Le proteine, che principalmente conferiscono al tessuto la loro struttura e resistenza allo strappo, sono riassunte sotto il termine proteine strutturali. Le proteine strutturali sono caratterizzate dal fatto che di solito non sono coinvolte nei processi metabolici enzimatico-catalitici.
Le scleroproteine, che sono annoverate tra le proteine strutturali, di solito formano molecole a catena lunga sotto forma di amminoacidi legati insieme, ciascuno dei quali è legato tra loro tramite legami peptidici. Le proteine strutturali hanno spesso sequenze amminoacidiche ricorrenti, che consentono alle molecole speciali strutture secondarie e terziarie come doppie o triple eliche, che portano a particolari resistenze meccaniche. Le proteine strutturali importanti e conosciute sono z. B. Cheratina, Collagene ed Elastina. La cheratina è una delle proteine strutturali che formano le fibre che danno struttura alla pelle (epidermide), ai capelli e alle unghie.
Con oltre il 24% di tutte le proteine presenti nel corpo umano, i collageni formano il più grande gruppo di proteine strutturali. Ciò che colpisce del collagene è che un amminoacido su tre è glicina e la sequenza glicina-prolina-idrossiprolina è accumulata. I collageni resistenti allo strappo sono i componenti più importanti di ossa, denti, legamenti e tendini (tessuto connettivo). A differenza del collagene, che difficilmente può essere allungato, l'elastina conferisce ad alcuni tessuti la capacità di allungarsi. L'elastina è quindi una componente importante nei polmoni, nelle pareti dei vasi sanguigni e nella pelle.
Funzione, effetto e compiti
Varie classi di proteine sono incluse nel termine proteina strutturale. Ciò che tutte le proteine strutturali hanno in comune è che la loro funzione principale è quella di dare struttura e forza al tessuto in cui si trovano. È richiesta un'ampia gamma delle proprietà strutturali necessarie. I collageni, che formano la proteina strutturale nei legamenti e nei tendini, tra le altre cose, sono estremamente resistenti allo strappo, poiché i legamenti ei tendini sono esposti a forti sollecitazioni in termini di resistenza allo strappo.
Come componente di ossa e denti, i collageni devono anche essere in grado di formare strutture a prova di rottura. Oltre alla resistenza allo strappo, altri tessuti del corpo richiedono un'elasticità speciale per potersi adattare alle rispettive condizioni. Le proteine strutturali, che appartengono al gruppo delle elastine, svolgono questo compito. Possono essere allungati e sono, in misura limitata, paragonabili alle fibre elastiche in tessuto. Le elastine consentono una rapida regolazione del volume nei vasi sanguigni, nei polmoni e in varie pelli e membrane che avvolgono gli organi e devono far fronte al cambiamento delle dimensioni degli organi. Anche nella pelle umana i collageni e le elastine si completano a vicenda per garantire compattezza e capacità di muovere la pelle.
Mentre i collageni nei legamenti e nei tendini garantiscono principalmente la resistenza alla trazione in una certa direzione, le cheratine, che fanno parte delle unghie delle mani e dei piedi, devono garantire una resistenza piatta (bidimensionale). Un'altra classe di proteine strutturali è costituita dalle cosiddette proteine motorie, che sono il componente principale delle cellule muscolari. La miosina e altre proteine motorie hanno la capacità di contrarsi in risposta a un certo stimolo neurale, provocando l'accorciamento temporaneo del muscolo durante l'utilizzo di energia.
Istruzione, presenza e proprietà
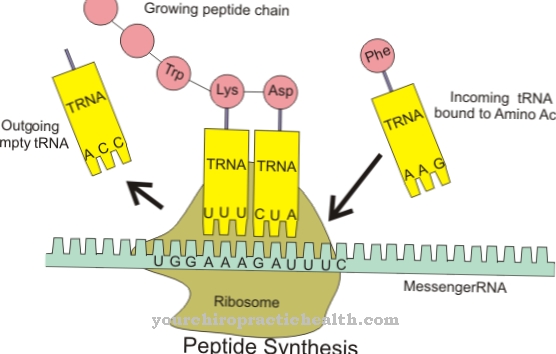
Le proteine strutturali, come altre proteine, sono sintetizzate nelle cellule. Il presupposto è che sia garantito l'apporto degli amminoacidi corrispondenti. Innanzitutto, diversi amminoacidi sono collegati per formare peptidi e polipeptidi. Queste parti di una proteina vengono messe insieme sul reticolo endoplasmatico ruvido per formare parti più grandi e quindi per formare una molecola proteica completa.
Le proteine strutturali che devono svolgere funzioni esterne alle cellule nella matrice extracellulare vengono marcate e trasportate nello spazio extracellulare per esocitosi per mezzo di vescicole secretorie. Le proprietà richieste delle proteine strutturali coprono un ampio spettro tra resistenza alla trazione ed elasticità. Le proteine strutturali normalmente si trovano solo come parte dei tessuti, quindi la loro concentrazione non può essere facilmente misurata direttamente. Non è quindi possibile fornire una concentrazione ottimale.
Malattie e disturbi
I complessi compiti che le varie proteine strutturali devono assumersi portano all'aspettativa che si possano verificare anche malfunzionamenti che portano a disturbi e sintomi. Può anche portare a malfunzionamenti all'interno della catena di sintesi perché per la sintesi sono necessari un gran numero di enzimi e vitamine.
I disturbi più evidenti si verificano quando le proteine corrispondenti non possono essere sintetizzate a causa di una fornitura insufficiente di aminoacidi. La maggior parte degli amminoacidi necessari può essere sintetizzata dall'organismo stesso, ma non gli amminoacidi essenziali che devono essere assunti dall'esterno sotto forma di cibo o integratori alimentari. Anche con un adeguato apporto di aminoacidi essenziali, l'assorbimento nell'intestino tenue può essere disturbato a causa di malattie o per l'ingestione di tossine o come effetto collaterale di alcuni farmaci e causare una carenza. Una malattia ben nota, anche se rara, in questo contesto è la distrofia muscolare di Duchenne.
La malattia è causata da un difetto genetico sul cromosoma X, quindi solo gli uomini sono direttamente colpiti. Il difetto genetico significa che la proteina strutturale distrofina, che è responsabile dell'ancoraggio delle fibre muscolari dei muscoli scheletrici, non può essere sintetizzata. Ciò porta a una distrofia muscolare con un decorso grave. Un'altra malattia ereditaria, anch'essa rara, porta alla mitocondriopatia. Diversi difetti genetici noti all'interno del DNA e del DNA mitocondriale possono causare mitocondri. Una composizione modificata di alcune proteine strutturali mitocondriali si traduce in un ridotto apporto energetico per l'intero organismo.