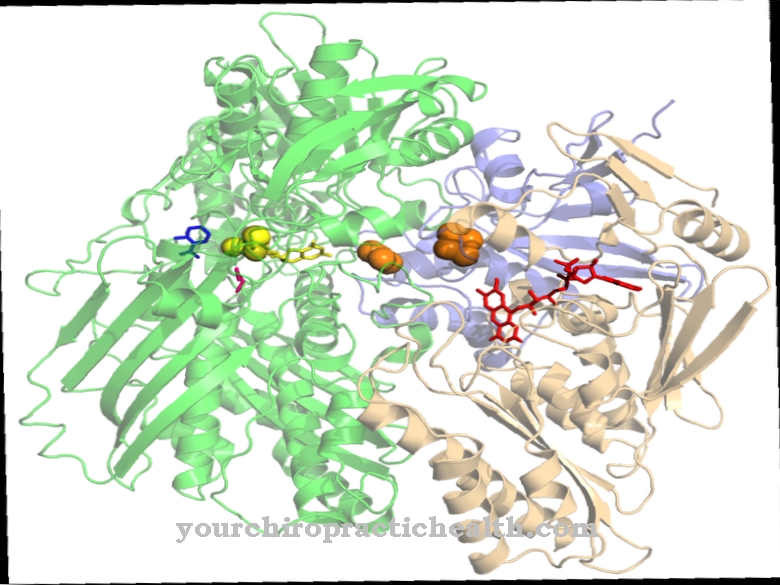
Nel inibizione allosterica o inibizione non competitiva Gli inibitori si legano al centro allosterico di un enzima e in questo modo ne riducono l'attività. Il legame provoca un cambiamento di conformazione che blocca parzialmente o completamente la funzione dell'enzima. L'inibizione allosterica è considerata una terapia per il cancro.
Cos'è l'inibizione allosterica?
.jpg)
L'inibizione è usata in medicina per descrivere un rallentamento, un ritardo o un blocco dei processi biologici. L'azione può arrestarsi a causa dell'inibizione. In biochimica, un'inibizione di solito corrisponde a un'inibizione enzimatica. Questo tipo di inibizione può essere competitivo o non competitivo. L'inibizione non competitiva è anche chiamata inibizione allosterica.
Con questo tipo di inibizione lo scopo è quello di legare gli inibitori al di fuori dei centri attivi dei processi da inibire. Gli inibitori utilizzati e i loro legami hanno un impatto negativo sulla funzione di un enzima coinvolto nel processo. Gli inibitori utilizzati sono noti anche come effettori allosterici e, a differenza dell'inibizione competitiva degli enzimi, non si accumulano nel centro del processo attivo, ma in altre posizioni del rispettivo enzima. Si trovano al centro allosterico dell'enzima e in questo modo cambiano la sua conformazione. Questo cambiamento di conformazione rende impossibile per l'enzima legare un substrato al sito attivo, o almeno lo rende difficile.
Funzione e compito
Gli enzimi sono componenti essenziali di ogni organismo. Le sostanze proprie del corpo sono coinvolte in tutti i processi metabolici e catalizzano la maggior parte delle reazioni biochimiche. Le cellule del corpo necessitano di determinati meccanismi per regolare i processi enzimatici al fine di influenzare l'attività specifica degli enzimi.
Gli enzimi sono spesso attivati tramite modifiche e la loro attività è regolata. Il legame a determinate sostanze può anche svolgere un ruolo nella regolazione delle attività enzimatiche. Le sostanze leganti sono anche chiamate effettori, che, a seconda del loro effetto sull'enzima, sono chiamati attivatori o inibitori. Gli attivatori aumentano l'attività enzimatica e promuovono la reazione associata. Gli inibitori riducono le attività enzimatiche e inibiscono le rispettive reazioni.
Gli inibitori nel centro attivo dell'enzima determinano la cosiddetta inibizione competitiva e occupano i siti di legame del centro attivo. In caso di inibizione non competitiva, l'inibitore si lega al centro allosterico di un certo enzima e determina così un cambiamento strutturale nel centro attivo. Come risultato di questi processi, l'enzima perde parzialmente o completamente la sua funzione. L'inibizione del feedback o inibizione del prodotto finale è una forma speciale di questo tipo di inibizione. Un prodotto di catene sintetiche inibisce allostericamente un enzima coinvolto nella sintesi.
Tutti i tipi di inibizione allosterica possono essere invertiti. Questo processo corrisponde alla rimozione degli effettori allostrici. Qualsiasi inibizione non competitiva si basa sul legame dell'inibitore I al centro allosterico dell'enzima E. Questo legame non influisce sul legame del substrato. L'inibitore può legarsi non solo all'enzima libero ma anche al suo complesso enzima-substrato, poiché non deve legarsi nella parte legante di un enzima. Anche il rispettivo substrato reagisce in modo analogo con un complesso enzima-inibitore. Tuttavia, un complesso enzima-inibitore-substrato formato non scinde il prodotto risultante. In singoli casi di inibizione non competitiva, il comportamento specifico degli inibitori può discostarsi più o meno dal caso normale.
Malattie e disturbi
L'inibizione dei processi enzimatici è un tipo di regolazione vitale nel corpo umano. Possono essere disturbati, ad esempio, da difetti genetici, soprattutto da mutazioni. Tali mutazioni possono influenzare vari elementi costitutivi del corpo umano che svolgono un ruolo nell'inibizione degli enzimi. Le conseguenze di non essere inibiti possono essere variate.
Ad esempio, livelli elevati di acido urico possono essere associati a disturbi dell'inibizione enzimatica. Se la concentrazione di acido urico nel sangue è aumentata e non viene escreta a sufficienza con le urine, i sali si depositano nelle articolazioni e possono quindi favorire la formazione di noduli gottosi. I cristalli di acido urico provocano reazioni infiammatorie nella pelle interna delle articolazioni, poiché sono associati ad un attacco acuto di gotta. L'aumento dell'acido urico può essere dovuto a un difetto dell'inibizione allosterica, che favorisce una maggiore biosintesi dei cosiddetti nucleotidi purinici.
Le inibizioni allosteriche non solo costituiscono la base di varie malattie, ma sono ora utilizzate anche dalla medicina a scopo terapeutico. L'inibizione allosterica del BCR-ABL, ad esempio, è un principio terapeutico corrente per la leucemia cromosomica positiva. La medicina moderna utilizza anche il principio dell'inibizione allosterica in altre aree della terapia del cancro. Gli scienziati stanno attualmente cercando inibitori nel contesto della ricerca sul cancro. In questo contesto, gruppi di ricerca statunitensi hanno scoperto, ad esempio, le proteine Ral, che sembrano essere di particolare interesse per la ricerca sul cancro. Tuttavia, non è ancora possibile parlare di un farmaco utilizzabile. Tuttavia, l'inibizione allosterica e non competitiva è un'area che contribuirà a plasmare il futuro della terapia del cancro.






.jpg)

.jpg)


.jpg)



.jpg)