deidrogenasi sono enzimi coinvolti nei processi di ossidazione. Si presentano in diverse varianti nel corpo umano e, ad esempio, catalizzano la degradazione dell'alcol nel fegato.
Cosa sono le deidrogenasi?
Le deidrogenasi sono enzimi specializzati. I biocatalizzatori accelerano la naturale ossidazione dei substrati. Una sostanza che si ossida perde elettroni. Nelle reazioni biologiche, le deidrogenasi separano gli anioni idrogeno da un substrato. Gli anioni sono particelle caricate negativamente.
In questo caso, un atomo di idrogeno accetta un elettrone e quindi riceve una carica elettrica negativa. La reazione vera e propria avviene nel centro attivo dell'enzima. Quando la deidrogenasi scinde l'anione idrogeno da un substrato, i cofattori assorbono gli elettroni e l'idrogeno. I cofattori sono molecole che svolgono un ruolo di aiuto nei processi enzimatici, ma non sono coinvolti nella scissione stessa. I cofattori delle deidrogenasi includono nicotinammide adenina dinucleotide (NAD +) e flavina adenina dinucleotide (FAD).
A differenza delle deidrogenasi, le disidratasi separano intere molecole d'acqua dal loro substrato. Le deidrogenasi possono anche causare la contro-reazione e contribuire alla riduzione anziché all'ossidazione. Durante la riduzione, una particella accetta gli elettroni invece di cederli. La biologia assegna le deidrogenasi alle ossido riduttasi. Questi tipi di enzimi esistono in ogni organismo vivente.
Funzione, effetto e compiti
Le deidrogenasi sono un gruppo composto da numerosi enzimi specializzati. I singoli enzimi hanno compiti diversi nel corpo umano. La biologia divide le varie deidrogenasi in ulteriori sottogruppi.
Le aldeide deidrogenasi (ALDH), ad esempio, formano un gruppo di deidrogenasi che si trovano principalmente nel fegato. Di norma, un ALDH è responsabile solo di un determinato substrato e non può contribuire all'ossidazione di altri substrati. Ad esempio, ALDH1A1, -1A2 e -1A3 processano la retina, che si trova nella vitamina A. Esistono, tuttavia, eccezioni a questa regola: ALDH2, ad esempio, può funzionare con substrati diversi e non è limitato a una sostanza.
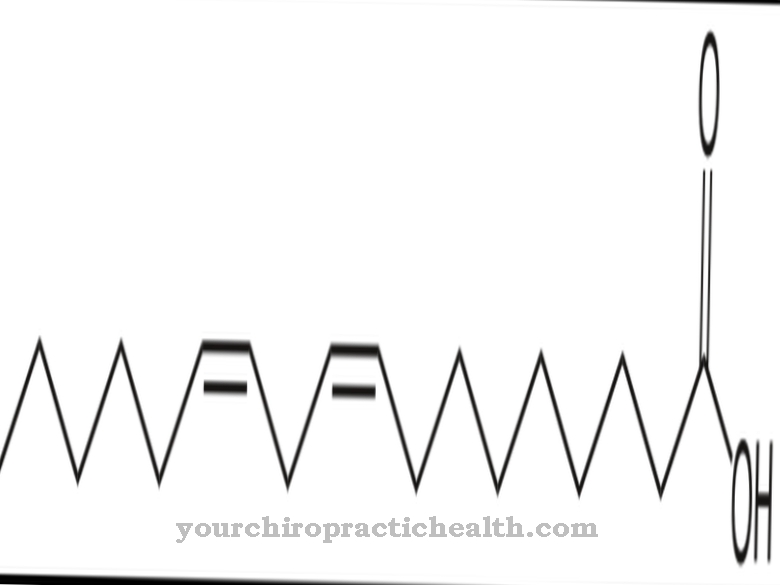
Nel fegato, le deidrogenasi scompongono l'alcol, ad esempio l'etanolo. Aiutano a purificare il sangue, che è uno dei compiti più importanti del fegato. La molecola di etanolo prima si aggancia al centro attivo di una alcol idrogenasi (ADH). Con l'aiuto dell'enzima, l'etanolo si ossida scindendo l'atomo di idrogeno caricato negativamente e dandolo al suo cofattore NAD +: l'ADH converte l'etanolo in acetaldeide in questo modo. L'acetaldeide, o etanale, è tossica e causa numerosi disturbi di salute.
Il cibo normalmente contiene solo una piccola quantità di etanolo, che il corpo può convertire rapidamente. Pertanto le quantità di etanale sono solo piccole. L'acetaldeide a sua volta è il substrato per ALDH. ALDH catalizza la conversione dell'acetaldeide in acido acetico prima che l'acido acetico possa essere ulteriormente scisso e scomposto in acqua e anidride carbonica. In questa forma, le molecole sono completamente innocue.
Istruzione, occorrenza, proprietà e valori ottimali
Le deidrogenasi si trovano principalmente nelle parti liquide del plasma cellulare o nei mitocondri. I corpi delle donne producono meno ADH rispetto ai corpi degli uomini. Ciò contribuisce al fatto che le donne sono in media più sensibili all'alcol.
I valori esatti delle diverse deidrogenasi variano non solo tra i diversi gruppi enzimatici, ma anche tra i diversi individui e gruppi etnici. Nell'Asia orientale e tra le popolazioni indigene dell'America e dell'Australia, i livelli di ADH sono in media inferiori rispetto, ad esempio, agli europei. Il genoma umano ha 19 geni noti che determinano l'ALDH. Questi geni sono sul dodicesimo cromosoma. Determinano l'ordine degli amminoacidi all'interno delle catene proteiche.
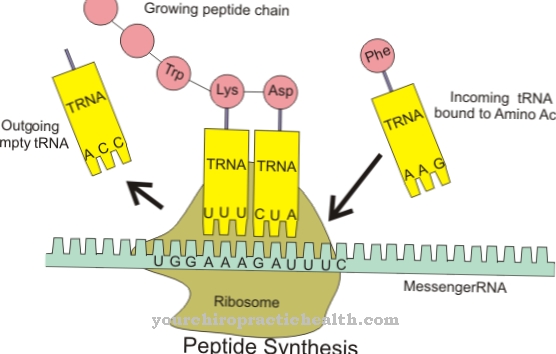
Le proprietà delle strutture proteiche derivano da questa sequenza. La forma delle deidrogenasi e quindi la loro funzione dipende anche dalla sequenza degli amminoacidi durante la sintesi. Ad esempio, ALDH2 è costituito da 500 aminoacidi. Di regola, le cellule sintetizzano le deidrogenasi, di cui in seguito hanno anche bisogno; Il trasporto delle sostanze non è quindi necessario.
Malattie e disturbi
Quando l'alcol viene scomposto nel corpo umano, l'acetaldeide si forma come stadio intermedio. La sostanza è velenosa; l'enzima ALDH deve quindi convertirlo in acido acetico il più rapidamente possibile. Con quantità maggiori di alcol, tuttavia, questo di solito non funziona completamente. Pertanto, i postumi di una sbornia persistono poche ore dopo aver consumato alcol.
La medicina lo chiama anche Veisalgia. I sintomi tipici sono mal di testa, malessere, nausea allo stomaco, vomito e perdita di appetito. La capacità di concentrazione e reazione è spesso limitata. La sensibilità delle persone all'alcol dipende, tra le altre cose, dalla quantità di deidrogenasi prodotte dalle cellule del fegato. Le deidrogenasi svolgono anche un ruolo nello sviluppo o nel mantenimento di varie malattie. L'aldeide grassa deidrogenasi (FALDH), ad esempio, svolge un ruolo centrale nello sviluppo della sindrome di Sjogren.
I principali sintomi del quadro clinico sono il ritardo mentale e la paraplegia spastica progressiva. La paraplegia spastica è una malattia neurodegenerativa ed è caratterizzata da paralisi spastica alle gambe. La sindrome di Sjögren-Larsson significa anche che lo strato corneo della pelle è più pronunciato e forma fiocchi di pelle chiaramente visibili (ittiosi). Oltre a questi tre sintomi cardinali, sono comuni i disturbi della retina. La causa della sindrome risiede nei geni che codificano per FALDH. A causa di una mutazione, il corpo non sintetizza correttamente il complesso enzimatico con FALDH. Di conseguenza, la concentrazione di alcoli grassi e aldeidi grasse nel plasma sanguigno aumenta.


.jpg)
.jpg)