Lisilidrossilasi rappresentano un gruppo di enzimi responsabili dell'idrossilazione dei residui di lisina all'interno delle proteine. Quindi contribuiscono principalmente alla struttura del tessuto connettivo. I disturbi nella funzione delle lisilidrossilasi si manifestano in malattie come lo scorbuto o la sindrome ereditaria di Ehlers-Danlos.
Cosa sono le lisilidrossilasi?
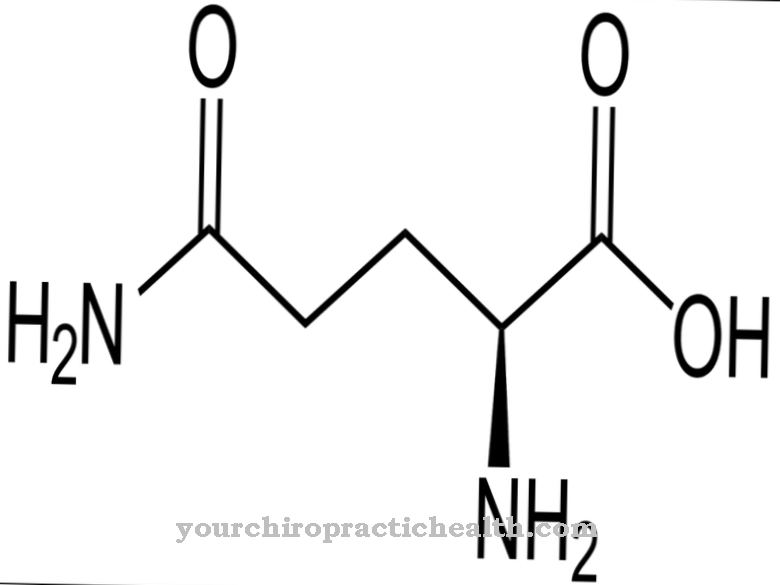
Le lisilidrossilasi sono enzimi il cui compito è catalizzare la modificazione post-traduzionale dell'amminoacido lisina incorporando un gruppo idrossile nell'idrossil lisina. Ciò rafforza il tessuto connettivo perché le sue catene proteiche hanno l'opportunità di collegarsi ulteriormente tramite i gruppi idrossilici.
La lisilidrossilasi umana è composta da 727 amminoacidi. Al gruppo delle idrossilasi appartengono anche le lisilidrossilasi, cioè enzimi che generalmente catalizzano l'incorporazione di gruppi idrossilici nelle molecole. Oltre alle lisil idrossilasi, le idrossilasi o ossidoreduttasi includono anche prolil idrossilasi, fenilalanina idrossilasi, tirosina idrossilasi o triptofano idrossilasi. Soprattutto insieme alle prolil idrossilasi, le lisilidrossilasi svolgono un ruolo importante nella funzione del tessuto connettivo. Entrambi i gruppi enzimatici richiedono il coenzima vitamina C per la loro funzione.
Funzione, effetto e compiti
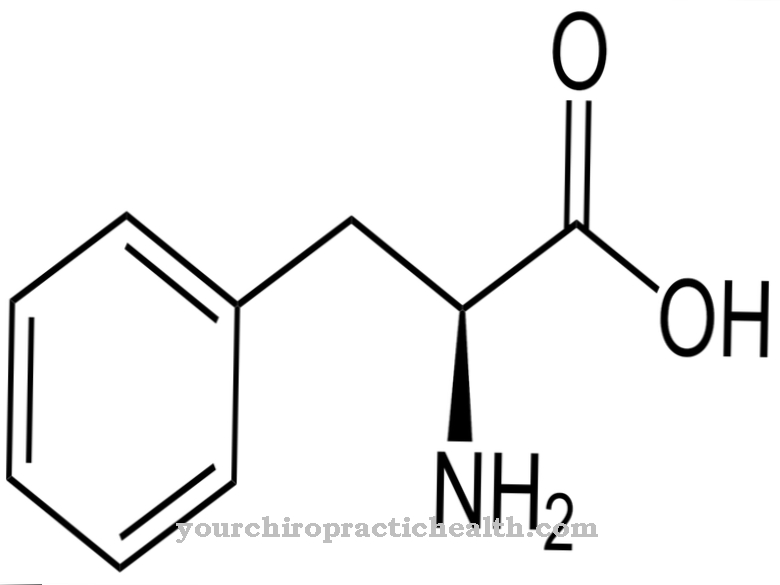
La funzione delle lisilidrossilasi consiste esclusivamente nel catalizzare l'incorporazione di gruppi idrossilici nei residui di lisina all'interno di una proteina. Nel corso di una modifica post-traduzionale, l'aminoacido idrossilammina viene formato dalla lisina.
Sebbene anche l'idrossilammina sia gratuita, non può essere incorporata nelle proteine in questa forma. La modifica post-traduzionale significa quindi la successiva conversione di questo amminoacido dopo che la proteina è stata costruita. Quando un atomo di idrogeno viene scambiato per il gruppo idrossile, a questo punto nella proteina viene incorporato un gruppo funzionale che può svolgere funzioni di collegamento. Con l'aiuto del gruppo idrossile, diverse catene proteiche possono legarsi insieme. Inoltre, le molecole di zucchero possono legarsi a questo gruppo funzionale. Entrambe le reazioni sono molto importanti, tra le altre cose, nello sviluppo del tessuto connettivo.
Il tessuto connettivo racchiude l'organismo e gli organi interni. Deve essere fermo e teso per poter distinguere tra organi funzionalmente differenti. Ciò è assicurato dalle proteine del tessuto connettivo, che contengono un'alta percentuale di aminoacidi lisina e prolina.A tale scopo, entrambi gli amminoacidi vengono successivamente parzialmente modificati dopo la loro incorporazione nella proteina mediante l'aggiunta di un gruppo idrossile. Come già accennato, con la prolina questa reazione è catalizzata dalle prolilidrossilasi e con la lisina dalle lisilidrossilasi. Dopo la formazione delle proteine, queste reazioni di modifica creano una rete di catene proteiche che rappresentano il tessuto connettivo stretto.
Senza la funzione di entrambi gli enzimi, lo sviluppo del tessuto connettivo funzionale non sarebbe affatto possibile. Tuttavia, entrambi gli enzimi funzionano solo con l'aiuto del coenzima acido ascorbico, cioè la vitamina C.Con enzimi strutturalmente alterati per mutazione o mancanza di vitamina C, questo può portare a interruzioni nella struttura del tessuto connettivo e quindi a gravi malattie.
Istruzione, occorrenza, proprietà e valori ottimali
Il gene PLOD1 è responsabile della codifica della lisil idrossilasi umana. Il nome PLOD1 deriva dal nome della lisil idrossilasi "Prokollagen-Lysin, 2-Oxoglutarat-5-Dioxygenase 1". Questo gene si trova sul cromosoma 1. Poiché viene prodotto costantemente nuovo tessuto connettivo, esiste anche una necessità permanente per la produzione di lisilidrossilasi. Una mutazione di questo gene può quindi avere conseguenze molto gravi per la salute dell'organismo.
Malattie e disturbi
I disturbi nella funzione delle lisilidrossilasi svolgono un ruolo particolarmente importante nello scorbuto e nella sindrome di Ehlers-Danlos. Lo scorbuto è noto come un'antica malattia marinara, che è causata dalla mancanza di vitamina C. La vitamina C, nota anche come acido ascorbico, funziona come un coenzima delle lisilidrossilasi e delle prolil idrossilasi. Se manca, gli amminoacidi lisina e prolina nella proteina del tessuto connettivo non possono più essere idrossilati.
Poiché c'è un costante accumulo e rottura delle proteine del tessuto connettivo, le catene proteiche sono sempre meno in grado di collegarsi in rete durante il periodo di carenza vitaminica. Il tessuto connettivo si allenta e non può più svolgere correttamente la sua funzione. Si verificano una varietà di sintomi, tra cui esaurimento generale, suscettibilità alle infezioni, sanguinamento delle gengive, perdita dei denti, scarsa guarigione delle ferite, gravi problemi della pelle, atrofia muscolare e molti altri danni alla salute. Lo scorbuto alla fine può portare alla morte per insufficienza cardiaca generale o infezioni gravi. Gli antichi marinai furono particolarmente colpiti perché non potevano assumere abbastanza vitamina C durante i lunghi viaggi in mare.
È stato dimostrato che la malattia guarisce immediatamente quando vengono somministrati determinati alimenti come i crauti. Solo in seguito è stato riconosciuto che la causa della malattia era una carenza di vitamina C. Lo scoppio della malattia del marittimo, lo scorbuto, è stato successivamente prevenuto nutrendo i marittimi con i crauti. Un'altra malattia, che può essere solo parzialmente attribuita a un difetto della lisilidrossilasi umana, è la sindrome di Ehlers-Danlos. La sindrome di Ehlers-Danlos è un termine collettivo per varie malattie ereditarie del tessuto connettivo con cause diverse. Questa sindrome è caratterizzata da una grave debolezza del tessuto connettivo.
La pelle è estensibile e le articolazioni sono smontabili. Una lisilidrossilasi geneticamente modificata innesca la sindrome di Ehlers-Danlos di tipo VI. Un gene mutato chiamato PLOD1, che si trova sul cromosoma 1, è responsabile di questo. L'enzima difettoso formato da questo non è più completamente funzionale e può catalizzare solo in modo insufficiente le reazioni di idrossilazione sulla lisina. Con i sintomi noti si sviluppa un tessuto connettivo debole e un coinvolgimento aggiuntivo degli occhi e degli organi interni. La sindrome di Ehlers-Danlos di tipo VI può essere ereditata come tratto autosomico recessivo.





.jpg)

.jpg)
.jpg)
.jpg)



.jpg)