Il enterochinasi è un enzima della mucosa duodenale la cui funzione è quella di attivare gli enzimi pancreatici. Si trova all'inizio di un'intera cascata di attivazione di enzimi digestivi. La disfunzione dell'enteropeptidasi porta a cattiva digestione e malassorbimento del cibo nell'intestino tenue.
Cos'è un'enteropeptidasi?
L'enteropeptidasi è un enzima della mucosa duodenale, che attiva gli enzimi digestivi del pancreas attivando il tripsinogeno in tripsina.
L'enteropeptidasi è secreta nel bordo del pennello della mucosa duodenale. In particolare, le ghiandole di liebekühn sono responsabili della secrezione. Le ghiandole di liebekühn sono depressioni tubulari nell'epitelio intestinale piccolo e grande. Nell'intestino tenue, si trovano tra i villi dell'intestino tenue. Le ghiandole, note anche come cripte di Lieberkühn, secernono un gran numero di enzimi oltre all'enteropeptidasi. La secrezione di enteropeptidasi viene stimolata quando il chimo, che è stato predigerito nello stomaco, entra nel duodeno. L'enzima da solo non influenza i componenti del cibo.
Solo l'attivazione dell'enzima tripsina mette in moto l'intera cascata di attivazione degli enzimi digestivi. L'enteropeptidasi, come la tripsina e le altre proteasi del pancreas, è una serina proteasi. Il centro attivo contiene la triade catalitica di acido aspartico, istidina e serina. In quanto endopeptidasi, l'enteropeptidasi scinde le proteine solo in determinati punti caratteristici con determinati motivi di riconoscimento nella sequenza amminoacidica. L'enzima si scinde sempre in corrispondenza del motivo di riconoscimento Asp-Asp-Asp-Asp-Lys. Con il tripsinogeno, l'esapeptide Val- (Asp) 4-Lys viene scisso, con la formazione di tripsina.
Funzione, effetto e compiti
La funzione dell'enteropeptidasi è quella di attivare gli enzimi digestivi nel pancreas. Inizia solo la prima fase di attivazione con la conversione del tripsinogeno in tripsina.
La tripsina è a sua volta una serina proteasi che scinde le proteine in base allo stesso motivo di riconoscimento caratteristico. Ora continua l'attivazione del tripsinogeno stesso. Allo stesso tempo, attiva altri enzimi pancreatici dai rispettivi precursori come chimotripsinogeno, pro-elastasi, pro-carbossipeptidasi, pro-fosfolipasi e proenteropeptidasi. Anche l'enteropeptidasi è inizialmente nel profilo inattivo. Quando il chimo entra nel duodeno, viene secreta non solo la proenteropeptidasi ma anche la duodenasi, che attiva il proforma dell'enteropeptidasi. Dopo l'inizio della cascata di attivazione, la tripsina assume l'attivazione di tutti gli enzimi pancreatici inclusi proenteropeptidasi e tripsinogeno.
L'attivazione della proenteropeptidasi a enteropeptidasi avviene in modo ancora più efficace attraverso l'azione della tripsina che attraverso la duodenasi. La presenza primaria degli enzimi digestivi nella loro forma inattiva è estremamente importante. L'azione delle proteasi in particolare è aspecifica. Tutte le proteine che contengono il caratteristico motivo di riconoscimento all'interno della molecola vengono scisse idroliticamente. Se gli enzimi fossero cataliticamente attivi immediatamente, le proteine del corpo sarebbero già digerite nel pancreas e nel dotto pancreatico. Di conseguenza, il pancreas si dissolverebbe da solo. L'attivazione avviene solo nel duodeno al di fuori delle ghiandole esocrine.
Gli enzimi possono iniziare qui ad abbattere i componenti del cibo senza attaccare i tessuti del corpo. Per evitare che gli enzimi vengano attivati prematuramente, un ulteriore inibitore della tripsina agisce nel dotto del pancreas. Tuttavia, il ruolo chiave per la cascata digestiva è svolto dalla tripsina. Una volta che questo enzima è attivato, l'attivazione di tutti gli enzimi digestivi, inclusa l'enteropeptidasi, non può essere interrotta.
Istruzione, occorrenza, proprietà e valori ottimali
Come tutte le serina proteasi, anche l'enteropeptidasi ha un effetto aspecifico e scinde le proteine utilizzando un caratteristico motivo di riconoscimento. L'enteropeptidasi consiste in una catena leggera e una pesante collegate da ponti disolfuro. Il dominio della serina proteasi si trova sulla catena leggera.
La catena pesante ha una massa molecolare da 82 a 140 kilodalton, con la massa molecolare della catena leggera da 35 a 62 kilodalton. La struttura della catena leggera dell'enteropeptidasi è simile alle altre serina proteasi tripsina e chimotripsina. La catena pesante è legata alla membrana e influenza la specificità dell'enzima. È stato riscontrato che la catena leggera isolata ha un effetto simile contro il caratteristico motivo di riconoscimento - (Asp) 4-Lys-, ma un effetto significativamente inferiore contro il tripsinogeno.
Malattie e disturbi
L'enteropeptidasi umana è codificata dal gene ENTK sul cromosoma 21. Una mutazione di questo gene può portare a gravi malattie nei bambini colpiti.
L'enzima non può più attivare gli altri enzimi digestivi. I componenti del cibo non vengono più scomposti e quindi non possono più essere assorbiti dall'intestino tenue. È principalmente una questione di cattiva digestione (degradazione insufficiente), che porta al malassorbimento dei componenti alimentari. Il corpo non è più adeguatamente fornito di sostanze nutritive. Si verificano difficoltà di crescita, crescita stentata e sintomi tipici di carenza proteica con sviluppo di edema. Allo stesso tempo, oltre alle proteine, i carboidrati ei grassi sono scarsamente assorbiti. Poiché i componenti del cibo non digerito entrano nell'intestino crasso e vengono scomposti lì dalla fermentazione e dai batteri putrefattivi, si verificano anche flatulenza, diarrea e dolore addominale.
Finora sono stati descritti 15 casi di deficit congenito di enteropeptidasi in tutto il mondo. Tuttavia, i sintomi della condizione sono molto più comuni. Un deficit di enteropeptidasi non deve essere sempre presente. Poiché la tripsina svolge un ruolo chiave nell'attivazione degli enzimi digestivi, anche un difetto o una carenza di tripsina porta a sintomi simili. Il trattamento di queste malattie è lo stesso in entrambi i casi. Gli enzimi vengono somministrati in forma attivata. Ci sono certamente molti altri casi non diagnosticati di deficit di enteropeptidasi.
Se la diagnosi è certa, potrebbe essere sostituita anche l'enteropeptidasi. Un deficit di enteropeptidasi è anche innescato secondariamente da gravi malattie intestinali.Malattie come la celiachia, l'accorciamento dell'intestino tenue, la carenza di lattasi o altre dovrebbero essere chiarite nella diagnosi differenziale.

.jpg)
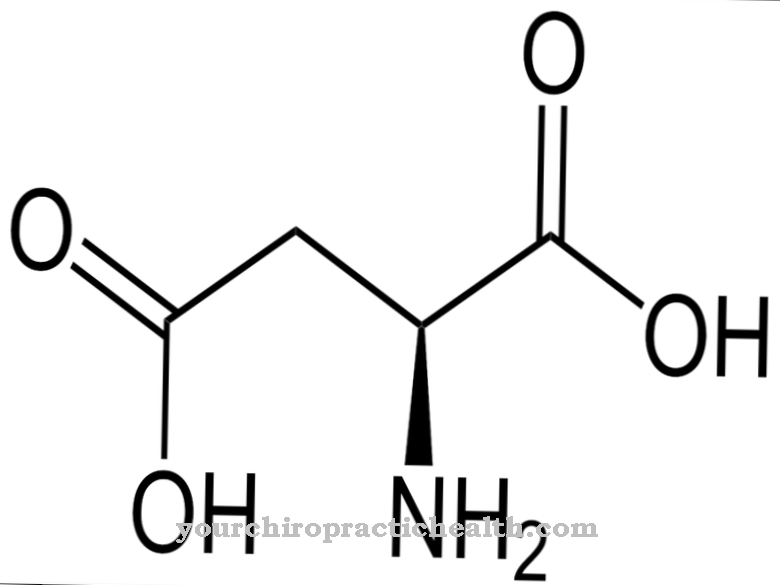
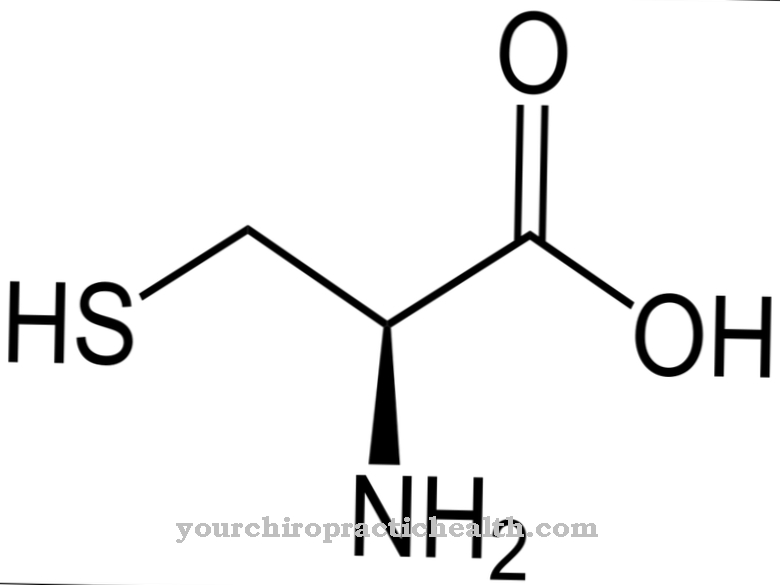

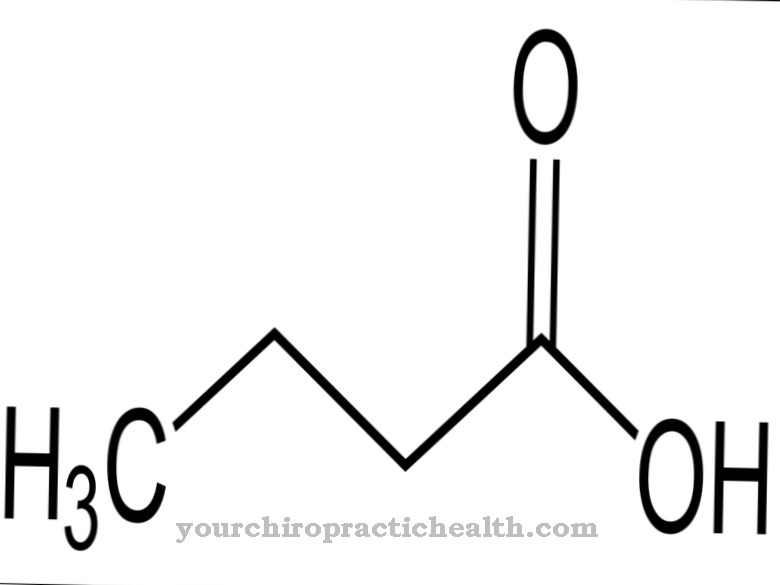
.jpg)

.jpg)


.jpg)



.jpg)