Il Induced-fit-La teoria risale a Koshland e corrisponde a un'estensione del principio di blocco dei tasti, che si basa sulla precisione dell'adattamento delle strutture anatomiche. L'adattamento indotto si riferisce a enzimi come la chinasi che cambiano la loro conformazione per formare un complesso enzima-ligando. In caso di difetti enzimatici, il principio di adattamento indotto può essere influenzato da disturbi.
Cos'è l'adattamento indotto?

Molti processi nel corpo funzionano sul principio del blocco della chiave o del guanto. Questo vale, ad esempio, per le connessioni articolate. La testa del giunto si innesta nella presa del giunto come una chiave in una serratura o una mano in un guanto. La porta si apre solo quando la chiave è esattamente nella serratura. Nello stesso contesto, alcune funzioni del corpo vengono aperte solo quando le strutture si incontrano esattamente.
L'indotto è una forma speciale del principio key-in-lock. Questa è una teoria per la formazione di complessi proteina-ligando, ad esempio un complesso enzima-substrato nel contesto di reazioni catalizzate da enzimi.
Daniel E. Koshland è considerato il primo a descrivere la teoria e la postulò per la prima volta nel 1958. A differenza del principio del blocco della chiave, la teoria dell'adattamento indotto non assume due strutture statiche. Nel caso in particolare dei complessi proteina-ligando, un cambiamento conformazionale nella proteina coinvolta dovrebbe consentire la formazione del complesso. Ligando e proteina, o meglio enzima, Koshland visti come dinamici e parlavano di un'interazione che spinge entrambi i partner a un cambiamento di conformazione per il bene della formazione complessa.
Funzione e compito
Esiste una specificità vincolante tra enzimi e substrati. Questa specificità vincolante implica il principio del blocco dei tasti. Ogni enzima ha un centro attivo. Per la formazione complessa con un ligando, questo centro è modellato con precisione in modo tale da corrispondere quasi perfettamente alla forma spaziale del substrato previsto.
Nel caso di molti enzimi, tuttavia, il centro attivo in ogni caso è in una forma non molto precisa fintanto che non è legato a un substrato. Questa osservazione sembra contraddire il principio lock-and-key, perché inizialmente gli enzimi ei loro ligandi sembrano adattare la loro forma.
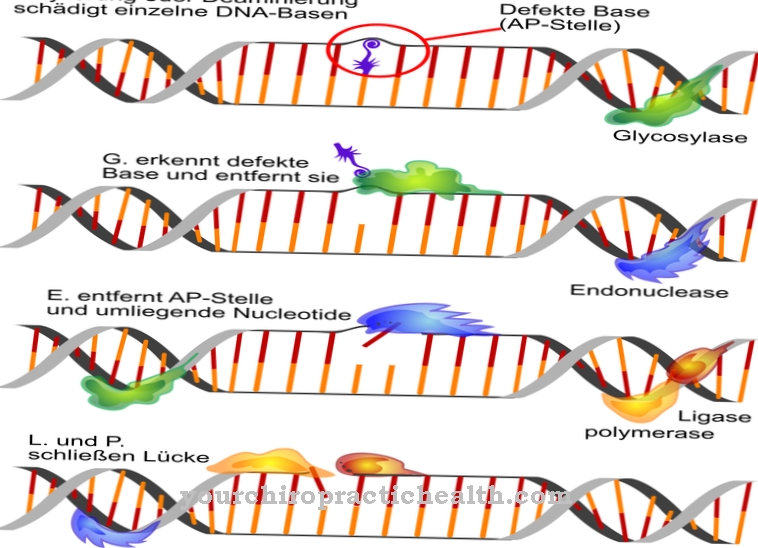
Non appena l'enzima si attacca a un ligando, vengono create interazioni intermolecolari. Queste interazioni a livello intermolecolare portano a un cambiamento nella conformazione dell'enzima. Per conformazione si intendono le varie possibili disposizioni dei singoli atomi in una molecola che risultano da una semplice rotazione attorno ad un asse. Il cambiamento nella conformazione degli enzimi corrisponde a un cambiamento nella disposizione spaziale delle loro molecole e consente solo la formazione di un complesso enzima-substrato.
Le esochinasi come enzimi catalizzano, ad esempio, la prima fase della glicolisi. Non appena questi enzimi entrano in contatto con il substrato glucosio, si può osservare un adattamento indotto nel senso della formazione di un "adattamento indotto". L'enzima esochinasi fosforila il suo glucosio ligando consumando ATP per formare un glucosio-6-fosfato.
La struttura dell'acqua assomiglia a quella all'interno del gruppo alcolico dell'atomo C6, che l'enzima fosforila durante la reazione. A causa delle piccole dimensioni, le molecole d'acqua potrebbero attaccarsi al centro attivo dell'enzima, in modo da generare l'idrolisi dell'ATP. Tuttavia, l'adattamento indotto consente alla esochinasi di catalizzare la conversione del glucosio con elevata specificità, in modo che l'idrolisi dell'ATP debba avvenire in misura ridotta. Con il meccanismo di adattamento indotto, la specificità del substrato aumenta.
Il principio all'interno dell'organismo umano può essere osservato in particolare nel caso delle chinasi. L'adattamento indotto non si applica a tutti i complessi ligando-recettore, poiché il cambiamento conformazionale di entrambi i partner è in molti casi limiti naturali.
Malattie e disturbi
Il principio di adattamento indotto è alterato nel caso di diversi difetti enzimatici. Nella fenilchetonuria, ad esempio, gli enzimi sono limitati nella loro attività o falliscono completamente. Di solito ciò è dovuto a un difetto genetico. Nella fenilchetonuria, l'enzima fenilalanina idrossilasi è difettoso. La fenilalanina non viene più convertita in tirosina e si accumula di conseguenza. Sorgono sostanze neurotossiche, così che oltre alle disabilità mentali, il paziente ha la tendenza ai crampi. I difetti enzimatici sono generalmente genetici e sono causati da una sequenza di amminoacidi codificata in modo errato nel DNA.
Le malattie metaboliche causate da difetti enzimatici e un tale principio di adattamento indotto disturbato sono note come enzimopatie. Difetti della piruvato chinasi sono presenti, ad esempio, in un gene PKLR che codifica in modo errato. Questo gene si trova sul locus genico 1q22 del cromosoma 1. Sono note varie mutazioni dell'allele PKLR della piruvato chinasi, che si manifestano come difetti nella forma R.
La malattia di Hers è di nuovo indicata come glicogenosi di tipo VI e appartiene al gruppo delle malattie da accumulo di glicogeno. È una malattia metabolica autosomica recessiva o legata all'X dovuta a difetti enzimatici. Più precisamente, la causa risiede in diversi difetti enzimatici nel sistema della fosforilasi chinasi all'interno del fegato e dei muscoli. In questo contesto, ad esempio, sono noti il difetto della fosforilasi-b-chinasi legata all'X nel fegato, il difetto della fosforilasi epatica dell'eredità autosomica recessiva e il fallimento combinato della fosforilasi-b-chinasi nel fegato e nei muscoli.
In relazione alla fosforilasi epatica, le mutazioni causali sono state localizzate sul gene PYGL e sono quindi sul cromosoma da 14q21 a q22. Il deficit combinato di fosforilasi del muscolo epatico è stato collegato a mutazioni nel gene PHKB nel locus 16q12-q13. Mutazioni causali nel gene PHKA2 sul locus Xp22.2-p22.1 sono state identificate per il difetto legato all'X nella fosforilasi chinasi epatica. Altre glicogenosi possono anche annullare l'effetto di adattamento indotto della chinasi corrispondente o renderlo più difficile.




.jpg)

.jpg)
.jpg)