elastasi rappresentano un gruppo di proteasi che sono strettamente correlate agli enzimi tripsina e chimotripsina. Appartengono alle serina proteasi. Finora sono noti per l'organismo umano nove enzimi appartenenti alle elastasi.
Cosa sono le elastasi?
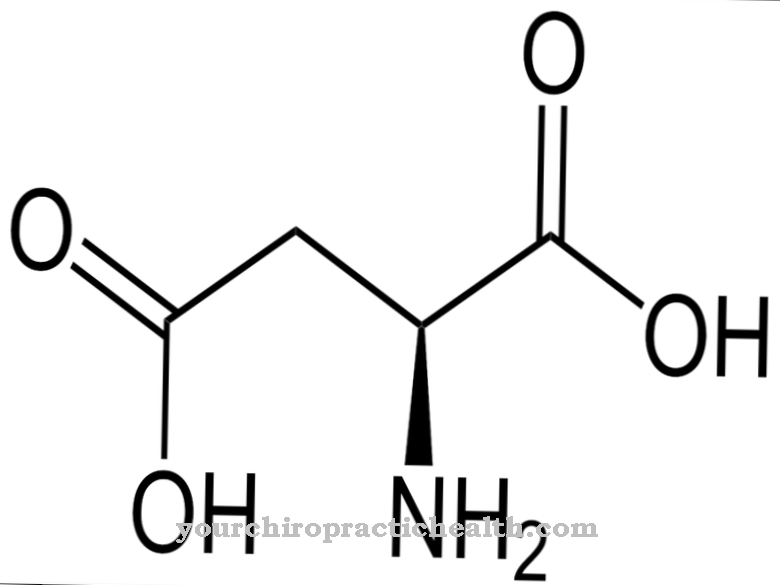
Le elastasi sono proteasi non specifiche che si verificano in tutti gli organismi animali e umani. Il nome deriva dal fatto che, tra le altre cose, sono in grado di abbattere l'elastina del corpo. Le elastasi appartengono alle serina proteasi.
Il loro centro attivo contiene la cosiddetta triade catalitica di acido aspartico, serina e istidina. Inoltre, le elastasi appartengono anche alle endoproteasi. Non scompongono gradualmente le proteine e le catene polipeptidiche, ma le suddividono in determinati amminoacidi e sequenze amminoacidiche caratteristiche. La proteina viene scomposta all'interno della catena peptidica. L'effetto delle elastasi non è specifico. In questo modo, anche le proteine del corpo possono essere scomposte dall'elastina. Pertanto, l'effetto di questi enzimi deve essere limitato dagli inibitori dell'elastasi. Viene fatta una distinzione tra due tipi di elastasi.
Sono presenti elastasi pancreatiche ed elastasi granulocitiche. Come suggerisce il nome, le elastasi pancreatiche (elastasi 1) sono secrete dal pancreas. L'elastasi granulocitaria (elastasi 2) si trova nei granulociti neutrofili. Una carenza di elastasi 1 nelle feci è considerata una prova di insufficienza pancreatica.
Funzione, effetto e compiti
Le elastasi hanno il compito di rompere i legami peptidici nelle proteine o nelle catene polipeptidiche. Durante il processo si formano catene peptidiche più piccole o singoli amminoacidi. L'elastasi pancreatica supporta le proteasi tripsina e chimotripsina nella scomposizione delle proteine alimentari.
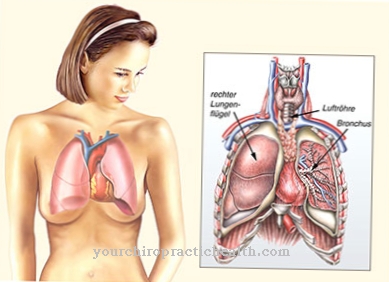
Si forma nel pancreas come proenzima inattivo (zimogeno) e, dopo essere stato rilasciato nell'intestino tenue, viene convertito nella forma attiva dall'azione della tripsina. Una catena parziale viene separata dallo zimogeno. L'elastasi 1 scompone in particolare l'elastina proteica della fibra. L'elastina fa parte del tessuto connettivo dei polmoni, dei vasi sanguigni e della pelle. Ha principalmente una funzione di supporto nell'organismo. L'elastina dà forma e sostegno agli organi. Poiché forma reti proteiche attraverso l'aggregazione di quattro molecole di lisina, non può essere scomposto da molte proteasi. Tuttavia, Elastase 1 ha la capacità di farlo. I componenti dell'elastina del cibo vengono scomposti e possono essere ulteriormente elaborati e scomposti in amminoacidi.
Sfortunatamente, l'effetto dell'elastasi non è specifico, quindi può anche attaccare le strutture di elastina del corpo. Per fare questo, il corpo produce proteine che inibiscono l'elastina che possono controllare gli effetti distruttivi dell'elastina. Queste proteine includono α1-antitripsina, alfa-2-macroglobulina o elafin. Il secondo gruppo di elastasi è rappresentato come ELA-2, l'elastasi granulocitaria. Il loro compito è abbattere i microrganismi fagocitati come parte di una risposta immunitaria alle infezioni. Tuttavia, hanno anche un effetto aspecifico e attaccano l'elastina del corpo. Se l'effetto delle proteine inibitrici dell'elastasi è limitato, il tessuto polmonare può essere distrutto, con la formazione di enfisema.
Istruzione, occorrenza, proprietà e valori ottimali
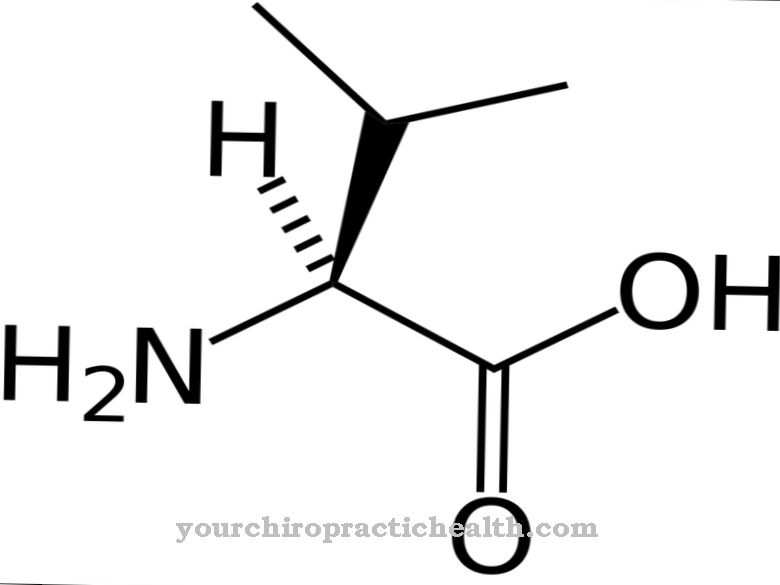
Indipendentemente da dove vengono sintetizzate, le elastasi sono importanti sostenitori del sistema immunitario nella lotta contro i germi gram-negativi nel tratto digerente, nei polmoni e sulle ferite. In tal modo, scindono le proteine corrispondenti sul lato carbossilico degli amminoacidi idrofobici, tra cui valina, glicina e alanina. Tuttavia, come già accennato, il loro effetto è sempre aspecifico.
Il corpo umano utilizza circa 500 milligrammi di elastasi ogni giorno. L'elastasi non viene scomposta nel corpo. Viene escreto immodificato nelle feci. La funzione del pancreas può essere controllata utilizzando la quantità escreta nelle feci. Anche la chimotripsina viene escreta con le feci. Tuttavia, la determinazione dell'elastasi può essere utilizzata più chiaramente per scopi diagnostici. La normale concentrazione di elastasi è di almeno 200 microgrammi per grammo di feci.
Malattie e disturbi
Se il livello di elastasi nelle feci è troppo basso, ciò indica insufficienza pancreatica. Se il valore è compreso tra 100 e 200 microgrammi per grammo di feci, si tratta di una disfunzione da lieve a moderata del pancreas.
Una grave insufficienza pancreatica è presente a valori inferiori a 100 microgrammi. Il rilevamento dell'elastasi nelle feci è una caratteristica diagnostica caratteristica di un pancreas ipoattivo. Questa è la funzione esocrina del pancreas. La formazione di insulina può essere inalterata. In caso di insufficienza pancreatica, vengono secreti troppo pochi enzimi digestivi. Questo vale per le proteasi, le lipasi e le amilasi. Molti componenti del cibo raggiungono l'intestino crasso non digeriti, dove vengono ulteriormente scomposti da batteri patogeni. I germi patogeni possono prosperare solo se ci sono ancora abbastanza componenti alimentari non digerite. Si sviluppano processi di putrefazione e fermentazione che portano a meteorismo, diarrea e disturbi addominali.
Poiché i grassi non vengono più scomposti, possono verificarsi feci grasse. La causa del pancreas iperattivo può essere dovuta a pancreatite acuta o cronica. La pancreatite di solito deriva dall'autodigestione di una parte del pancreas da parte dei succhi digestivi non drenanti. L'uscita pancreatica può essere ridotta a causa di tumori o calcoli biliari. Sono possibili anche disturbi del drenaggio dovuti a malformazioni. La pancreatite cronica a lungo termine porta a una ridotta funzionalità del pancreas con ridotta produzione di enzimi. Se c'è un deficit di elastasi di elastasi 2 a causa di un difetto genetico, il sistema immunitario del paziente affetto è indebolito. Le infezioni pericolose per la vita si verificano costantemente.
Se c'è una mancanza di inibitori dell'elastasi come l'alfa-1-antitripsina o una maggiore attività dell'elastasi nella polmonite, la funzione polmonare può essere gravemente limitata. A lungo termine, da questo si sviluppa l'enfisema polmonare. In caso di deficit genetico di alfa-1-antitripsina, viene utilizzata la terapia sostitutiva per tutta la vita con alfa-1-antitripsina geneticamente modificata.



.jpg)

.jpg)
.jpg)